
世界卫生组织日前警告称,近期新冠肺炎疫情再次出现加速传播趋势。全球累计确诊病例从6月29日突破1000万例到7月10日突破1200万例仅用时12天。
美国约翰斯·霍普金斯大学最新数据显示:截至北京时间13日6时34分,全球新冠确诊病例达12859834例,死亡病例为567957例。美国是全球疫情最严重的国家,确诊病例达3297501例,死亡病例为135155例。
随着一些国家开始“解封”,疫情陆续出现反弹。在新冠疫苗正式面世之前,WHO呼吁所有国家始终如一地采取“全政府、全社会”的防控措施。
在全球严峻的疫情笼罩之下,截至2020年7月13日,世界卫生组织WHO共批准全球范围内15款新冠检测产品。美国FDA共紧急授权全球范围内的137款新冠检测产品。
2家国内 IVD上市企业时获NMPA、WHO EUL、FDA EUA三项认证
根据统计,有2家国内体外诊断企业同时获得NMPA(中国国家药品监督管理局)、FDA EUA (美国食品药品管理局)、WHO EUL (世界卫生组织)认证或授权,分别是硕世生物、华大基因,2家均为上市企业。
硕世生物创立于2010年,坐落在国家级医药高新科技园区——江苏泰州中国医药城。2019年12月5日在上海证券交易所科创板上市,股票代码“688399”。公司拥有多重荧光定量PCR、生物芯片、酶化学等现代生物学技术平台及智能化仪器设备平台,从事传染性疾病、遗传性疾病、肿瘤等领域的产品研发、生产及销售。受疫情影响公司2020年第一季度收入比上年同期暴涨276.21%,归属上市公司股东净利润暴涨近7倍。
2020年4月16日,硕世生物新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)获得国家药品监督管理局(NMPA)颁发的医疗器械注册证。2020年6月18日,2019-nCoV核酸检测试剂盒(荧光PCR法) 获美国FDA EUA紧急使用授权。2020年7月9日,2019-nCoV核酸检测试剂盒(荧光PCR法)获 WHO EUL认证。
华大基因成立于1999年,伴随着国际人类基因组计划" 中国部分"的正式启动而诞生。2017年7月14日在深圳证券交易所创业上市,股票代码“300676”。华大基因2020年第一季度实现实现营业收入7.91亿元,同比增长35.78%;实现归母净利润1.40亿元,同比增长42.59%。
2020年1月26日,华大基因新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)、新型冠状病毒2019-nCoV核酸检测试剂盒(联合探针锚定聚合测序法)、基因测序系统、2019-nCoV核酸分析软件获得国家药品监督管理局(NMPA)颁发的4项医疗器械注册证。2020年3月26日,2019-nCoV核酸检测试剂盒(荧光PCR法)获美国FDA紧急使用授权。2020年5月7日,全资子公司 BGI Europe A/S的产品2019-nCoV核酸检测试剂盒(荧光PCR法)列入WHO EUL 清单。
多家跨国企业同时获WHO EUL、FDA EUA认证
同时通过WHO EUL、FDA EUA认证的跨国企业有业界知名的丹纳赫(旗下塞沛、贝克曼)、罗氏、雅培、西门子、珀金埃尔默。
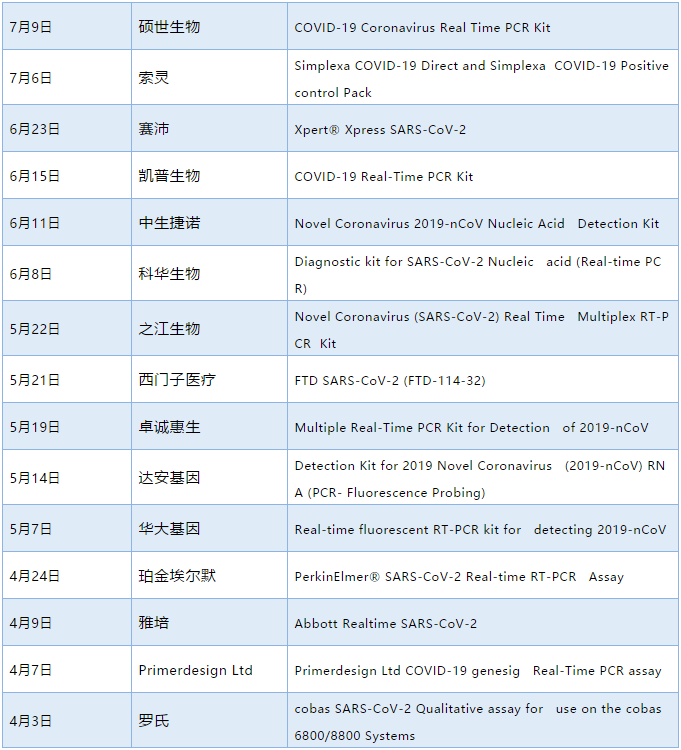
15款新冠检测产品列入WHO EUL一览
列入WHO EUL 清单的国内体外诊断生产企业已达8家,分别是硕世生物、凯普生物、中生捷诺、科华生物、之江生物、卓诚惠生、达安基因、华大基因。
国外企业包括:罗氏、雅培、珀金埃尔默、赛沛、西门子、索灵等。

清单如下(按时间倒序排序):
137款新冠检测产品获美国FDA EUA紧急使用授权
随着美国新冠疫情持续大幅增长,FDA批准中国新冠检测产品数量明显上升。目前全球有137款新冠检测产品获 FDA EUA紧急使用授权,国内体外诊断企业已超过10家,值得一提的是杭州的企业表现较为亮眼。
部分获授权国内企业如下:
杭州安旭生物科技股份有限公司获批日期:7月6日获批产品:Assure COVID-19 IgG/IgM Rapid Test Device
杭州莱和生物技术有限公司获批日期:6月19日获批产品:LYHER Novel Coronavirus (2019-nCoV) IgM/IgG Antibody Combo Test Kit (Colloidal Gold)
硕世生物获批日期:6月18日获批产品:COVID-19 Coronavirus Real Time PCR Kit
必欧瀚生物技术(合肥)有限公司获批日期:6月18日获批产品:Biohit SARS-CoV-2 IgM/IgG Antibody Test Kit
北京泛生子基因科技有限公司获批日期:6月5日获批产品:Genetron SARS-CoV-2 RNA Test
杭州博拓生物科技股份有限公司获批日期:6月4日获批产品:RightSign COVID-19 IgG/IgM Rapid Test Cassette
东方生物(全资子公司美国衡健生物科技有限公司)获批日期:5月29日获批产品:COVID-19 IgG/IgM Rapid Test Cassette (Whole Blood/Serum/Plasma)
圣湘生物科技股份有限公司获批日期:5月4日Novel Coronavirus (2019-nCoV) Nucleic Acid Diagnostic Kit
安图生物获批日期:4月24日获批产品:Anti-SARS-CoV-2 Rapid Test
复星医药获批日期:4月17日获批产品:Fosun COVID-19 RT-PCR Detection Kit
迈克生物获批日期:4月15日获批产品:SARS-CoV-2 Fluorescent PCR Kit
科维斯生物获批日期:4月6日获批产品:Gnomegen COVID-19 RT-Digital PCR Detection Kit
华大基因获批日期:3月26日获批产品:Real-Time Fluorescent RT-PCR Kit for Detecting SARS-CoV-2
抗原、抗体产品约占20%
137款获FDA EUA 授权新冠检测产品中,以核酸检测产品为主,占比约80%。抗原、抗体检测产品占比约20%。
抗体检测试剂获批的企业主要有:
贝克曼库尔特、罗氏、雅培、奥森多、安图生物、欧蒙、西门子、BD、东方生物、莱和生物、博拓生物、必欧瀚生物、安旭科技、Diazyme Laboratories, Inc.、InBios International, Inc.、Babson Diagnostics, Inc.、Emory Medical Laboratories、Vibrant America Clinical Labs、Mount Sinai Laboratory等。
抗原检测产品获批企业主要有:
7月2日,FDA批准碧迪BD公司的 Veritor System for Rapid Detection of SARS-CoV-2 ,该产品为便携式COVID-19抗原即时检测,15分钟内可获检测结果。 据悉,这已是BD公司批准的第3款新冠检测产品。
5月8日,FDA批准Quidel Corporation公司的Sofia 2 SARS Antigen FIA ,这是抗原类产品首次获得FDA批准。
137款新冠检测产品一览

2020年8月21日-23日,第十七届国际检验医学暨输血仪器试剂博览会将于在南昌绿地国际博览中心举行,超过1000家体外诊断相关企业参展。届时,百家具有出口资质的新冠检测产品生产企业与您相约英雄城,我们不见不散。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设