热门搜索:分会介绍 | 会员名单 | 行业资讯

近日,中国健康传媒集团主办的“第六届全国医疗器械科学监管与发展研讨会”在广州召开。来自全国20多个省(区、市)药监局、部分市县监管部门以及50余家医疗器械企业代表近200人参加会议。
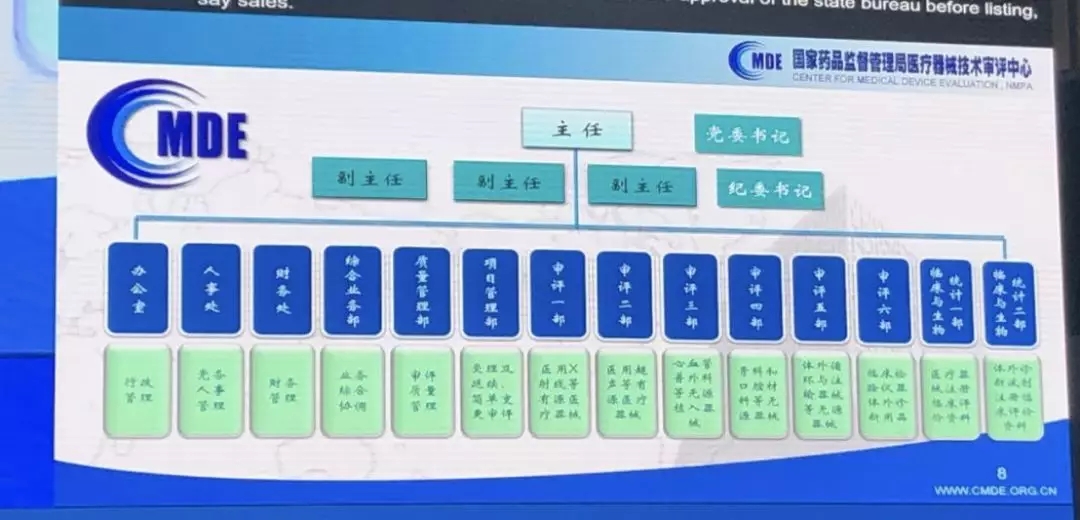
在研讨会现场,国家药品监督管理局医疗器械技术审评中心(以下简称“器审中心”)副主任许伟表示,2019年是器审中心各项改革工作深化推进之年,也是多项改革措施落地实施之年。器审中心将不断改进医疗器械审评机制体制,不断加强质量管理,更加完善和鼓励创新制度,更加优化审评方式和流程。

▽器审中心副主任许伟(图片取自中国食品药品监管网)
许伟副主任透露,器审中心按“三定”方案新增设的项目管理部、临床与生物统计一部、临床与生物统计二部3个内设机构将于6月24日正式启动运行。其中,1)项目管理部负责受理及延续、简单变更审评;2)临床与生物统计一部负责医疗器械注册临床评价资料;3)临床与生物统计二部负责体外诊断试剂注册临床评价资料。
▽第六届全国医疗器械科学监管与发展研讨会现场
与此同时,电子申报、立卷审查、项目管理人制度、小组审评、分路审评、集体决策等也将普遍推开。在国家市场监管总局和国家药监局的领导和支持下,器审中心将在创新、质量、效率、体系和能力多维度上持续努力,不断提高。为保障公众用械安全有效,促进医疗器械行业创新发展作出积极贡献。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设