
省食品药品监督管理局:
为认真贯彻落实国家和我省关于降低实体企业成本的相关政策要求,促进实体企业降本减负,经研究决定,降低药品及医疗器械产品注册费收费标准,现就有关事项明确如下:
一、国产药品及境内第二类医疗器械产品注册费按照附件规定的收费标准执行。
二、收费使用省财政厅统一印制的非税收入票据,纳入全省统一的非税收入系统收缴,收费资金全额上缴省级国库,实行收支两条线管理。
三、有关收费单位应认真做好收费报告和收费公示工作,向当地价格、财政主管部门报告本单位基本情况、收费项目变动情况和年度收费情况,在收费场所醒目位置公示收费项目、范围、对象、标准、期限、依据、减免规定、执收方式以及监督电话12358。
四、以上规定从2018年9月20日开始执行,有效期3年。有效期到期前60个工作日,你局应按照规定程序和《国家发展改革委 财政部关于印发〈行政事业性收费标准管理办法〉的通知》第九条规定(发改价格规〔2018〕988号)向省物价局、省财政厅重新提出制定收费标准的建议。
五、《福建省物价局 福建省财政厅关于制定药品及医疗器械产品注册费收费标准的函》(闽价费〔2017〕318号)同时废止。
附件1:
国产药品注册费收费标准表
单位:元/次
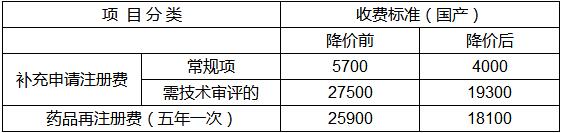
备注:属于福建省食品药品监督管理局批准的改变国内药品生产企业名称、国内药品生产企业内部改变药品生产场地(不需要现场核查)补充申请事项,免收其相应注册费。
附件2:
境内第二类医疗器械产品注册费收费标准表
单位:元/次
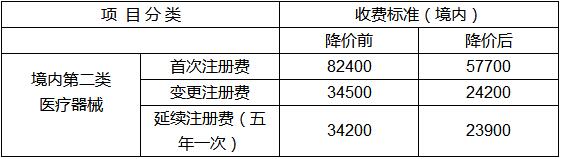
备注:
1.按医疗器械管理的体外诊断试剂的注册收费适用本标准;
2.以上事项的每次收费标准以注册单元计,不计规格型号或包装规格;
3.属于《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》注册登记事项变更申请的,不收取变更注册费;
4.符合《中小企业划型标准规定》(工信部联企业[2011]300号)条件的小微企业注册申请人提出的创新医疗器械产品首次注册申请,免收其注册费。创新医疗器械产品是指国家食品药品监督管理总局创新医疗器械审查办公室依据总局《创新医疗器械特别审批程序(试行)》(食药监械管[2014]13号),对受理的创新医疗器械特别审批申请组织有关专家审查并在政府网站上公示后,同意进入特别审批程序的产品。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设