热门搜索:分会介绍 | 会员名单 | 行业资讯

广东省食品药品监督管理局
通 告
2018年 第189号
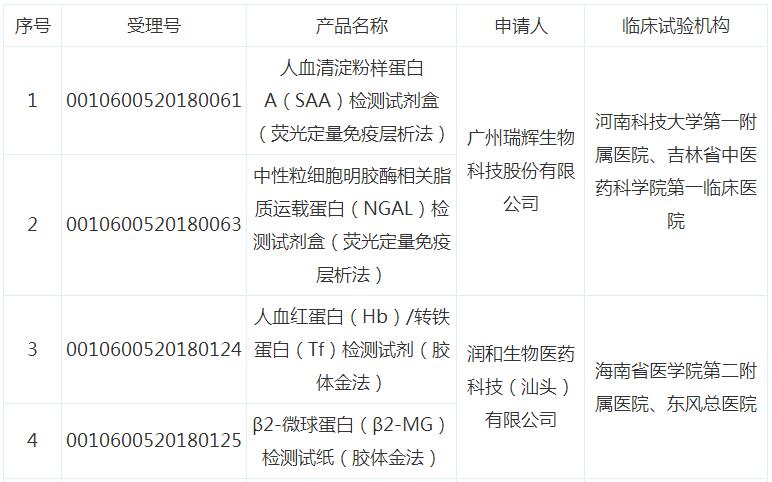
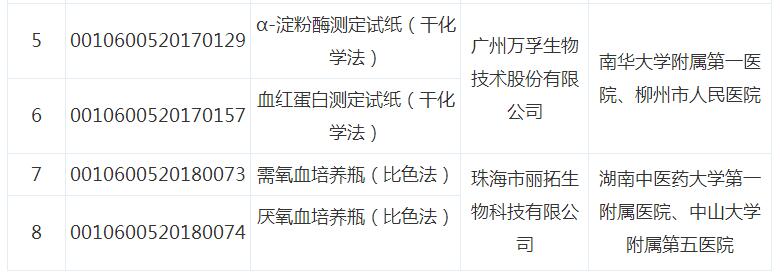
为贯彻实施中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),加强医疗器械临床试验监督管理,根据2018年重点工作安排,广东省食品药品监督管理局抽取广州瑞辉生物科技股份有限公司的人血清淀粉样蛋白A(SAA)检测试剂盒(荧光定量免疫层析法)(受理号:0010600520180061)等8个在审第二类医疗器械注册申请项目(见附件),将于8月下旬至9月上旬组织对其临床试验数据的真实性和合规性开展现场监督检查。
具体检查时间和人员安排另行通知。
特此通告。
附件:广东省2018年第一期医疗器械临床试验监督抽查项目
广东省食品药品监督管理局
2018年8月8日
附件:
广东省2018年第一期医疗器械临床
试验监督抽查项目
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设