热门搜索:分会介绍 | 会员名单 | 行业资讯

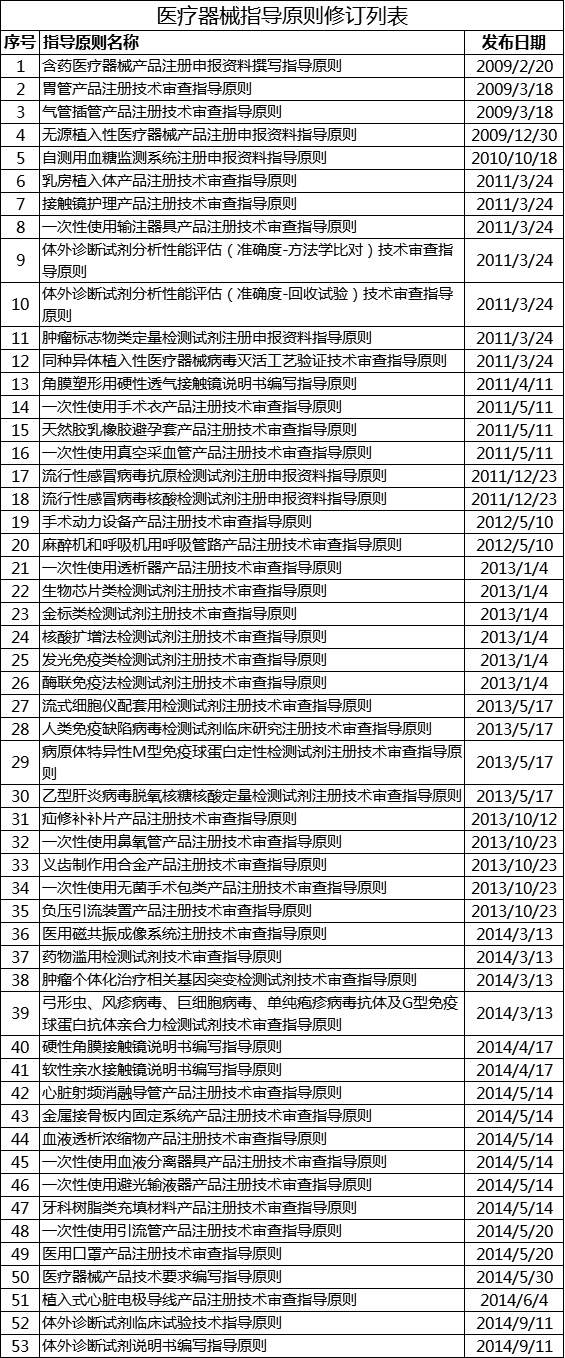
为进一步提高医疗器械技术审评工作的质量和效率,完善医疗器械注册技术审评指导原则(以下简称“指导原则”)体系,根据《医疗器械注册技术审查指导原则制修订工作管理规范》(药监办〔2018〕13号)相关要求,器审中心拟于近期启动2021年度指导原则修订工作,修订重点为2014年以前发布的指导原则(附件1),现面向社会征集相关指导原则修订内容的意见和建议,对于其它指导原则,若有意见和建议,可一并提供。
请各单位按照相关要求填写修订建议表,以电子邮件形式于4月1日前反馈至器审中心。
联 系 人:褚明磊
联系电话:010-86452957
电子邮箱:zdyz@cmde.org.cn
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设