热门搜索:分会介绍 | 会员名单 | 行业资讯

40年来我国的体外诊断产业有了长足的进步和发展,伴随着改革开放的红利,全国体外诊断产业相关法规与政策,体外诊断产品相关注册原则、技术、标准日趋完善。
体外诊断产品主要由诊断设备(仪器)和诊断试剂构成。根据我国《医疗器械分类目录》标准,体外诊断设备属于临床检验分析仪器类。
体外诊断注册技术审查指导原则旨在指导注册申请人对医疗器械注册申报的准备工作,同时也为技术审评部门审评提供参考,这既加强了医疗器械注册工作的监督和指导,又进一步提高了注册审查质量。对于体外诊断行业而言,这是产品上市之路的“必修书”。相关标准凝合了专家的智慧结晶,也给企业研发产品等提供了必要的依据。
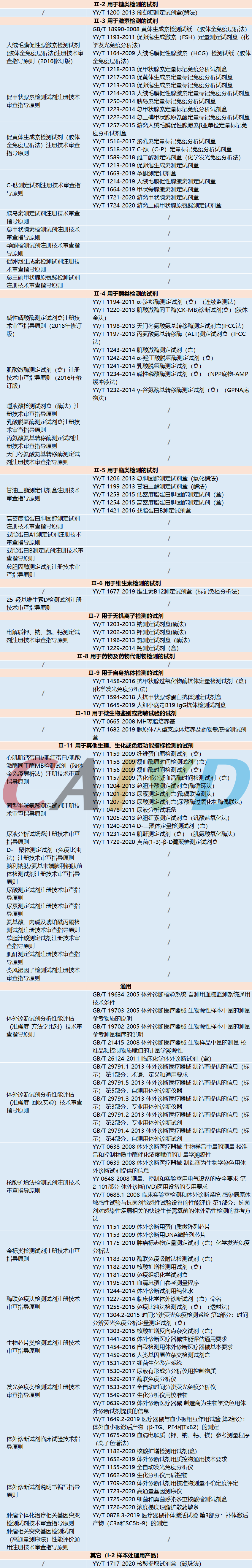
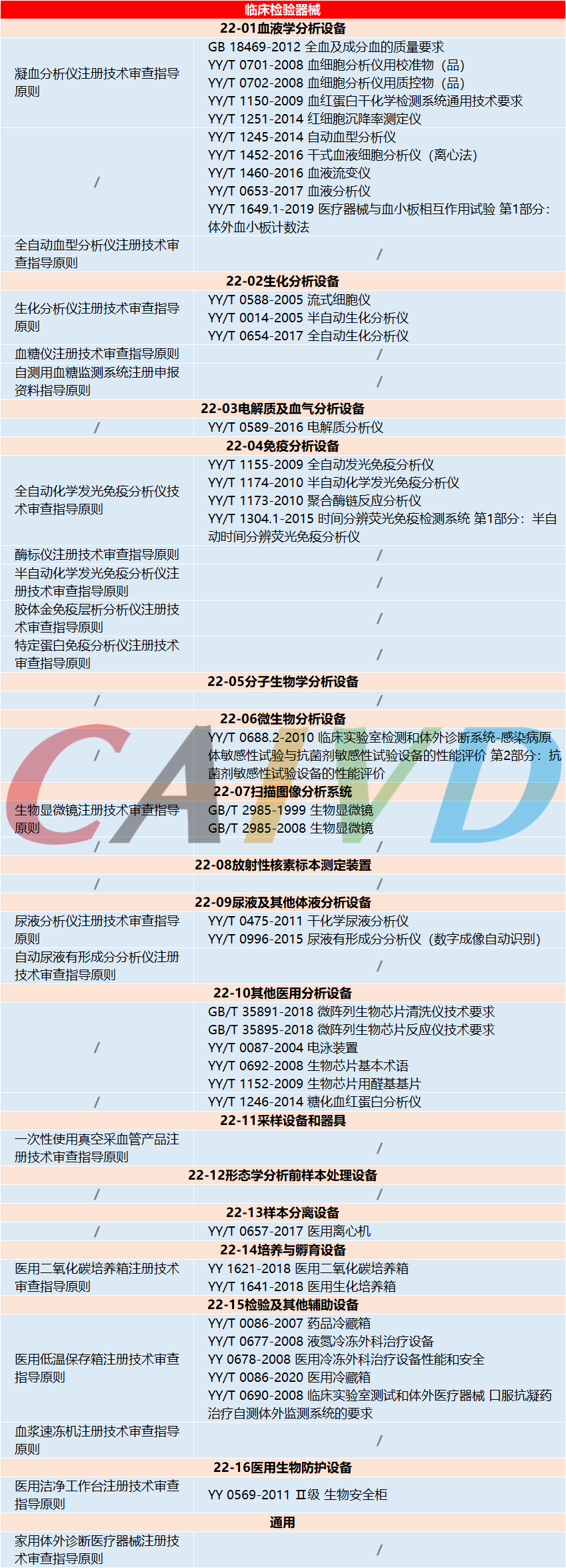
目前已发布的体外诊断试剂注册指导原则及相关标准涵盖了致病性病原体、血型、组织、基因检测、遗传性疾病、药品、治疗药物靶点、肿瘤标志物、变态反应、流式技术、蛋白质、糖类、激素、酶类、酯类、维生素、无机离子、药物及药物代谢物检测、自身抗体、微生物鉴别或药敏试验、生理、生化或免疫功能指标等方面,临床检验器械注册指导原则及相关标准涵盖了血液、生化、免疫、系统、体液、辅助等方面。详细如下:

邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设